时间:2025-10-31 15:05
阿尔茨海默病(AD)治疗领域迎来重大突破。一项发表于Nature子刊Signal Transduction and Targeted Therapy的研究报道了一种基于多价靶向策略的新型纳米药物,通过精准调控血脑屏障(BBB)上的LRP1受体运输路径,实现了脑内Aβ的高效清除和长期认知功能恢复。该研究由四川大学华西医院、西班牙巴塞罗那科学技术研究所等多个团队合作完成,为AD治疗提供了全新范式。

BBB在AD发病机制中的作用日益受到重视。研究表明:
(1)LRP1是介导Aβ跨BBB清除的关键受体
(2)在AD进程中,LRP1表达显著下降,且从内皮细胞向周细胞转移
(3)LRP1运输路径决定其命运:PACSIN2通路促进跨细胞运输,而Rab5通路导向溶酶体降解
(4)病理状态下,高亲和力Aβ聚集体将LRP1偏向Rab5降解通路,形成恶性循环
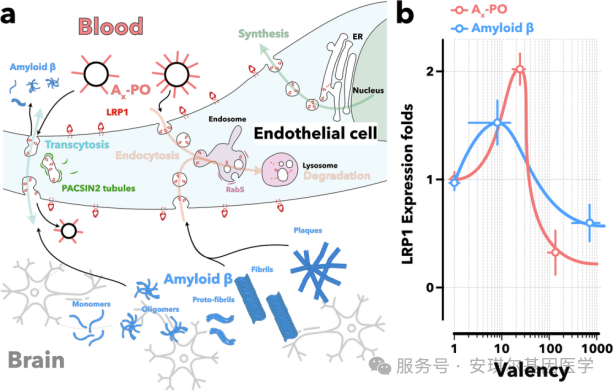
研究团队基于对LRP1运输机制的深入理解,设计了创新性的治疗策略:
1.配体-受体相互作用的精准调控
传统策略:单一配体,固定亲和力
本研究的突破:采用多价配体展示系统,通过精确控制配体密度(每囊泡40个angiopep-2配体)实现中等亲和力结合
2.运输路径的重编程
A₄₀-POs与LRP1的中等亲和力结合优先激活PACSIN2介导的管状运输通路
该通路绕过降解性内体-溶酶体系统,促进LRP1的循环利用
同时抑制Rab5介导的降解通路,阻止LRP1的内化降解
3.受体稳态的重建
PACSIN2通路的激活使LRP1表达水平上调78%
恢复BBB内皮细胞的Aβ清除能力
重建神经血管单元的功能耦合
1.Aβ清除效率惊人
(1)单次注射A₄₀-POs后2小时:
①脑内Aβ水平降低45%(从8603.6降至4236.3 ng/mL)
②血浆Aβ水平升高8倍(从85.3升至673.5 ng/mL)
(2)PET-CT成像显示Aβ信号减少46.25%
(3)组织透明化3D成像证实全脑Aβ体积减少41%
2.BBB表型显著修复
(1)LRP1与内皮细胞标志物CD31的共定位恢复至野生型水平
(2)PACSIN2表达上调,Rab5表达下调
(3)STED超分辨显微镜显示LRP1在血管壁形成簇状分布,提示活跃的跨细胞运输
3.认知功能长期改善
(1)Morris水迷宫实验显示:
①治疗组小鼠空间学习和记忆能力与野生型相当
②在反向导航测试中表现出良好的认知灵活性
③治疗效果持续6个月以上
(2)巢构建测试和蔗糖偏好实验证实生活质量和情绪状态显著改善
A₄₀-POs的理性设计:
(1)核心材料:PI(OEG)₁₀MA₂₀-PDPA₁₂₀嵌段共聚物
(2)靶向单元:angiopep-2肽段(LRP1特异性配体)
(3)配体密度:每囊泡40个配体(经计算优化)
(4)尺寸控制:通过自组装形成均一纳米囊泡
优化的治疗窗口:
(1)配体密度不足(A₁、A₀-POs):无法有效激活运输
(2)配体密度过高(A₂₀₀-POs):引发过度内化和降解
(3)A₄₀-POs:精确平衡结合强度和内化速率
本研究代表了AD治疗策略的根本范式转变——从“克服BBB障碍”到“修复BBB功能”。A₄₀-POs不仅是药物递送载体,更是BBB功能的调节剂,通过重构内源性清除机制实现治疗目标。
技术优势:
(1)快速起效:2小时内即可观察到显著的Aβ清除
(2)持久改善:单次治疗效果维持6个月
(3)多重获益:同时实现Aβ清除、BBB修复和认知改善
(4)机制明确:基于精确的分子设计和对细胞运输的深入理解
临床前景:
(1)可能克服抗体类药物起效慢、受体耗竭等局限
(2)适用于早期干预和疾病修饰治疗
(3)技术平台可扩展至其他神经退行性疾病(如帕金森病、肌萎缩侧索硬化等)
这项研究在多个层面具有开创性意义:从科学性来讲,首次将多价相互作用的概念应用于BBB受体运输调控,建立了从分子设计到生理功能的完整理论框架。对LRP1运输路径的精准调控为受体靶向治疗提供了新范式。在技术层面上A₄₀-POs代表了纳米药物设计的新高度——不仅考虑靶向效率,更关注对细胞生物学过程的精确调控。这种“智能”纳米系统能够感知并纠正病理状态下的运输失衡。在临床研究中,研究展示的快速、持久疗效为AD治疗带来了新希望。特别值得注意的是,认知改善的持久性提示该治疗可能真正改变了疾病进程,而非仅仅是症状缓解。
随着进一步的研究优化和临床转化,这种基BBB功能修复的策略有望成为AD治疗的重要突破,为数百万患者带来新的治疗选择。
参考文献:Chen J et al. Signal Transduction and Targeted Therapy (2025) 10:331.DOI: 10.1038/s41392-025-02426-1